إجابات أسئلة مراجعة الوحدة الثالثة
نشاط الفلزات
السؤال الأول:
أوضح المقصود بكل من: أكسيد الفلز، تفاعل الإحلال، تآكل الفلز.
أكسيد الفلز: مركب كيميائي ينتج من تفاعل الفلز مع الأكسجين.
تفاعل الإحلال: التفاعل الذي يحل فيه العنصر النشط محل العنصر الأقل نشاطاً.
تآكل الفلز: تكون طبقة جديدة على سطح الفلز تنتج من تفاعل الفلز مع مكونات الهواء، ما يجعل الفلز أضعف وأكثر هشاشة.
السؤال الثاني:
أفسر ما يأتي:
أ- يحفظ فلز الصوديوم تحت الكيروسين.
لمنع وصول الأكسجين والماء إليه؛ فهو يتفاعل مع الهواء الجوي والرطوبة.
ب- يمكن استخلاص الحديد من أكاسيده مثل Fe2O3 باستخدام الألمنيوم.
لأن الألمنيوم أكثر نشاطاً من الحديد؛ فهو يحل محل الحديد في مركباته.
ج- على الرغم من أن البلاتين أقل نشاطاً من القصدير، إلا أن علب المواد الغذائية المصنوعة من الحديد تطلى من الداخل بالقصدير لا البلاتين.
بسبب التكلفة العالية لطلاء علب المواد الغذائية بالبلاتين.
السؤال الثالث:
قطع مدرس الكيمياء عينات من فلزات لينة بالسكين، وتركها بحذر معرضة للهواء بعد أن كلف مجموعات من طلابه حساب الزمن المستغرق في تحول سطح كل فلز في مكان القطع من لامع إلى باهت. وكانت النتائج كما يأتي:
الصوديوم (57) ثانية، الكالسيوم (دقيقتان ونصف)، البوتاسيوم (13) ثانية، الليثيوم (92) ثانية.
أ- أحدد الفلز الأكثر سرعة في تفاعله مع الهواء.
البوتاسيوم.
ب- أكتب معادلة التفاعل للفلز الأقل سرعة في تفاعله مع غاز الأكسجين.
2Ca(s) + O2(g) → 2CaO(s)
السؤال الرابع:
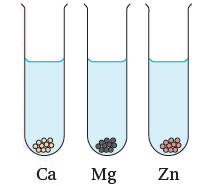 أقارن: تفاوت سرعة تفاعل الفلزات Ca, Mg, Zn مع الماء (في الشكل المجاور) برسم فقاقيع الغاز الناتجة في كل أنبوب.
أقارن: تفاوت سرعة تفاعل الفلزات Ca, Mg, Zn مع الماء (في الشكل المجاور) برسم فقاقيع الغاز الناتجة في كل أنبوب.
- يتفاعل Ca مع الماء بسهولة.
- يتفاعل Mg مع الماء بطيئاً.
- لا يتفاعل Zn مع الماء.
السؤال الخامس:
أكتب اسم فلز واحد تنطبق عليه الخصائص في كل من العبارات الآتية، ثم أكتب معادلة كيميائية موزونة للتفاعل:
أ- فلز يتفاعل مع الماء بسرعة متحركًا على سطحه.
صوديوم.
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
ب- فلز يتفاعل ببطء مع حمض الهيدروكلوريك المخفف.
مغنيسيوم.
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
السؤال السادس:
أتأمل سلسلة النشاط المجاورة، ثم أحدد الفقرة الصحيحة في ما يأتي:
أ- الفلز Y يتفاعل مع حمض الهيدروكلوريك HCl ويُنتج غاز الهيدروجين.
ب- الفلز X يتفاعل مع الماء.
ج- الفلز Y لا يحل محل الفلز X في المحلول المائي لكبريتاته X2SO4.
السؤال السابع:
الجدول الآتي يوضح نتائج تجارب تفاعلات الفلزات: A,B,C,D مع الماء ومع حمض الهيدروكلوريك المخفف:
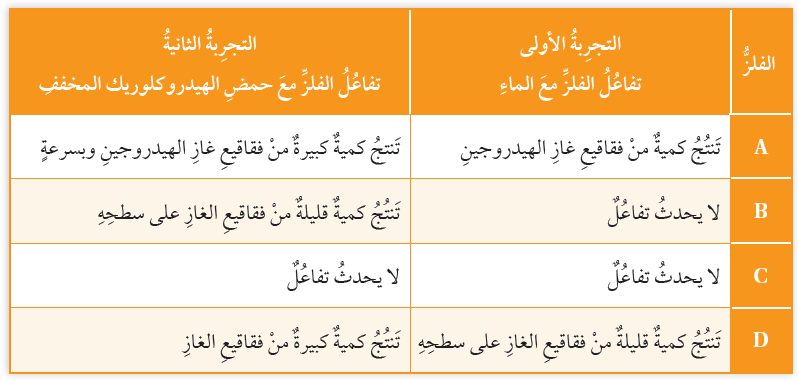
أ- أحدد مثالين لإرشادات السلامة الواجب اتباعها عند إجراء التجارب في الجدول.
- لبس قفازات.
- لبس نظارة واقية.
ب- أرتب الفلزات في الجدول عمودياً، بدءاً بالفلز الأكثر نشاطاً.
A > D > B > C
ج- أختار رمز فلز من الجدول يمثل فلز النحاس، مبرراً اختياري.
الفلز C يمثل النحاس؛ لأن النحاس لا يتفاعل مع كل من الماء وحمض الهيدروكلوريك.
د- أتوقع: أي الفلزات في الجدول يمكن أن يكون الكالسيوم، ثم أكتب معادلة تفاعل الكالسيوم مع الحمض HCl.
الفلز A يمثل الكالسيوم.
Ca(s) + 2HCl(aq) → CaCl2(aq) + H2(g)
السؤال الثامن:
عند تفاعل المغنيسيوم مع محلول كبريتات النحاس CuSO4 يترسب النحاس على هيئة ذرات النحاس الصلبة. أكتب معادلة تمثل التفاعل الناتج.
Mg(s) + CuSO4(aq) → MgSO4(aq) + Cu(s)
السؤال التاسع:
المعلومات الآتية تمثل بيانات مجموع تجارب أجريت على عدد من الفلزات الافتراضية الآتية:
(A, B, C, D, E). أستخدم هذه المعلومات في بناء سلسلة نشاط كيميائي لهذه الفلزات:
- يرسب الفلز D الفلزات الأخرى في محاليلها المائية على هيئة عناصر حرة.
- يحل الفلز C محل الفلز A عند تسخين مسحوق C مع مسحوق من أكسيد A.
- يستخلص الفلر B الفلز E من خاماته، ولا يمكنه استخلاص الفلز A من خاماته.
D > C > A > B > E
السؤال العاشر:
أتأمل سلسلة النشاط الآتية التي تتضمن فلزين مجهولين، ثم أجيب عن الأسئلة التي تليها:
أ- هل يتفاعل الفلز R مع الماء البارد؟ أبرر إجابتي.
يتفاعل؛ لأنه يقع بين البوتاسيوم والكالسيوم وكلاهما يتفاعلان مع الماء البارد.
ب- هل يتفاعل الفلز E مع الماء البارد؟ أبرر إجابتي.
لا يتفاعل؛ لأنه يقع بين الخارصين والحديد وكلاهما لا يتفاعلان مع الماء البارد.
ج- هل يرسب الفلز R ذرات الفلز Mg في محلول كبريتات المغنيسيوم MgSO4؟ أبرر إجابتي.
نعم؛ لأنه أكثر نشاطاً من المغنيسيوم.
د- هل يتفاعل الفلز E مع حمض الهيدروكلوريك HCI المخفف؟ أبرر إجابتي.
يتفاعل؛ لأنه يقع بين الخارصين والحديد وكلاهما يتفاعلان مع حمض الهيدروكلوريك.
هـ- هل يمكن استخدام الفلز E في استخلاص الخارصين من أكسيده ZnO؟
لا يمكن؛ لأنه أقل نشاطاً من الخارصين.
السؤال الحادي عشر:
أختار الإجابة الصحيحة لكل فقرة في ما يأتي:
1- الفلز الأسرع في تفاعله مع الماء البارد مما يأتي هو:
أ- الخارصين.
ب- المغنيسيوم.
ج- الصوديوم.
د- النحاس.
2- المادتان المتفاعلتان لتكوين ملح كلوريد المغنيسيوم هما:
أ- مغنيسيوم وماء.
ب- مغنيسيوم وأكسجين.
ج- مغنيسيوم وبخار الماء.
د- مغنيسيوم وحمض الهيدروكلوريك.
3- اسم الملح الناتج من تفاعل فلز الكالسيوم مع حمض الهيدروكلوريك هو:
أ- هيدروكلوريك الكالسيوم.
ب- ثاني أكسيد الكربون.
ج- كلوريد الكالسيوم.
د- كلورات الكالسيوم.
4- الغاز الناتج عند تفاعل الفلزات مع حمض الهيدروكلوريك HCI هو:
أ- الهيدروجين.
ب- الأكسجين.
ج- النيتروجين.
د- ثاني أكسيد الكربون.
5- يوضح الشكل المجاور رموزاً افتراضية لعينات من الفلزات تتفاعل مع الماء، وعليه، فإِن الترتيب الصحيح لها مبتدئًا برمز الفلز الأكثر نشاطًا هو:
أ- ABCD
ب- ADCB
ج- BADC
د- DBCA
6- الفلز الذي يقاوم التآكل في ما يأتي هو:
أ- المغنيسيوم.
ب- الألمنيوم.
ج- الخارصين.
د- النحاس.
7- التفاعل غير القابل للحدوث بناءً على سلسلة نشاط الفلزات هو:
أ- CuO(s) + Mg(s) → Cu(s) + MgO(s)
ب- PbO(s) + Zn(s) → Pb(s) + ZnO(s)
ج- CaO(s) + Zn(s) → Ca(s) + ZnO(s)
د- CuO(s) + Pb(s) → Cu(s) + PbO(s)
8- الظرف المناسب لتكون صدأ الحديد هو توافر:
أ- الأكسجين.
ب- الأكسجين والماء.
ج- الماء.
د- الهيدروجين والماء.
9- فلز R يقع بين الكالسيوم والخارصين، وعليه، فإن الطريقة الأنسب للتحقق من ذلك تجربة تفاعله مع:
أ- الأكسجين.
ب- الماء.
ج- الأكسجين والماء.
د- حمض الهيدروكلوريك.
إعداد : شبكة منهاجي التعليمية
15 / 02 / 2025
النقاشات
Ward
شكرا♥️
إضافة رد
0 ردود
aeeeaeee الخطيب
شكرا
إضافة رد
0 ردود