إجابات أسئلة مراجعة الدرس
سلسلة النشاط الكيميائي وتآكل الفلزات
السؤال الأول:
الفكرة الرئيسة: أوضح كيف رتبت الفلزات في سلسلة النشاط الكيميائي.
رتبت الفلزات وفقاً لشدّة تفاعلها مع الهواء والماء وحمض الهيدروكلوريك.
السؤال الثاني:
أوضّح المقصود بكل من: سلسلة النشاط الكيميائي، صدأ الحديد، عملية الجلفنة.
سلسلة النشاط الكيميائي: ترتيب الفلزات وفقاً لنشاطها النسبي، من حيث الأكثر نشاطاً إلى الأقل نشاطاً، ويطلق عليها أيضاً سلسلة التفاعلية.
صدأ الحديد: طبقة هشّة من أكسيد الحديد Fe2O3.nH2O (تشير n إلى عدد جزيئات الماء المرتبطة بأكسيد الحديد) تتكون على سطح الحديد نتيجة تفاعله مع أكسجين الهواء الجوي بوجود الماء أو بخار الماء.
عملية الجلفنة: تغطية الحديد بطبقة من فلز آخر أكثر نشاطاً من الحديد، مثل الخارصين، حيث تتآكل بدلاً من الحديد ويمنع تآكله.
السؤال الثالث:
أفسر ما يأتي:
أ- يعد النحاس فلزاً مناسباً لصناعة العملة الفلزية.
لأنه فلز قليل النشاط.
ب- لا يمكن حفظ محلول كبريتات الحديد في وعاء من الألمنيوم.
لأن الألمنيوم أكثر نشاطاً من الحديد؛ فالألمنيوم يطرد الحديد من المركبات التي تحتوي على الحديد.
السؤال الرابع:
أجرى مجموعة من الطلبة تجربة لمقارنة تفاعل أربعة فلزات مع حمض الكبريتيك H2SO4 المخفف. ودونوا ملاحظاتهم في جدول النتائج الآتي. أدرس هذه النتائج، ثم أجيب عن الأسئلة التي تليها:

أ- أحدد المؤشرات التي لاحظها الطلبة التي تدل على حدوث التفاعل.
تكون فقاقيع من الغاز، صوت الأزيز، سخونة الأنبوب.
ب- أسمي الغاز المبعث في أثناء التفاعل.
غاز الهيدروجين.
ج- أستخدم النتائج في ترتيب هذه الفلزات في سلسلة نشاط مختصرة.
Mg > Zn > Fe > Cu
د- أتنبأ: بالاعتماد على المعلومات الآتية التي زود بها الطلبة عن بعض الفلزات بعد انتهائهم من بناء السلسلة، أتنبأ بمواقع هذه الفلزات في السلسلة ثم أعيد ترتيبها:
- إذا أضيف الكالسيوم إلى الحمض، فإن التفاعل يكون خطراً، ولا يفضل إجراؤه في المختبر.
- إذا أضيف الرصاص إلى الحمض، ستتكون بعض الفقاقيع، ولكن، ببطء شديد.
- إذا أضيف الألمنيوم إلى الحمض، فسيكون هناك كثير من الفقاقيع، ويمكن سماع صوت أزيز التفاعل، وقد تنتج حرارة من التفاعل.
Ca > Mg > Al > Zn > Fe > Pb > Cu
السؤال الخامس:
أتوقع: أي التفاعلات الآتية قابل للحدوث بالاعتماد على سلسلة نشاط الفلزات؟
Al(s) + CuSO4(aq) → Al2(SO4)3 + Cu(s)
Mg(s) + CaCl2(aq) → MgCl2(aq) + Ca(s)
Ca(s) + ZnCl2(aq) → CaCl2(aq) + Zn(s)
التفاعل الأول قابل للحدوث؛ لأن الألمنيوم أنشط من النحاس.
التفاعل الثاني غير قابل للحدوث؛ لأن المغنيسيوم أقل نشاطاً من الكالسيوم.
التفاعل الثالث قابل للحدوث؛ لأن الكالسيوم أنشط من الخارصين.
السؤال السادس:
أتوقع: بالاعتماد على سلسلة نشاط الفلزات، هل يمكن استخلاص الخارصين Zn من أكسيده ZnO باستخدام فلز الرصاص Pb ؟ أبرر إجابتي.
لا يمكن؛ لأن فلز الرصاص أقل نشاطاً من فلز الخارصين؛ فلا يستطيع أن يطرد الخارصين من مركباته.
السؤال السابع:
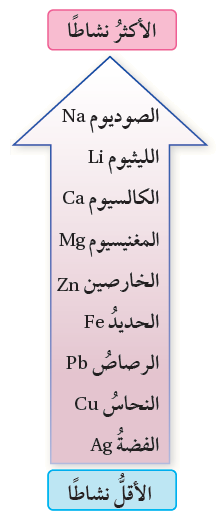 أدرس سلسلة نشاط الفلزات المبينة في الشكل؛ ثم أجيب عن الأسئلة الآتية:
أدرس سلسلة نشاط الفلزات المبينة في الشكل؛ ثم أجيب عن الأسئلة الآتية:
أ- أحدد الفلز الذي يحفظ تحت الكاز.
الصوديوم.
ب- أحدد الفلزات التي يمكن أن تتفاعل مع الماء البارد.
الصوديوم والليثيوم والكالسيوم.
ج- أحدد فلزاً لا يتفاعل مع الماء البارد، إنّما يتفاعل مع الماء الساخن أو بخار الماء.
المغنيسيوم.
د- أتوقع: أي هذه الفلزات لا يظهر له يتفاعل مع أكسجين الهواء.
الفضة.
هـ- أتوقع: ماذا يحدث لفلزي الكالسيوم والرصاص عند تسخين كل منهما مع غاز الأكسجين؟
يتفاعل كل من الكالسيوم والرصاص مع الأكسجين عند تسخينهما، إلا أن تفاعل الكالسيوم أسرع.
و- أتوقع: أي هذه الفلزات يمكن أن يوجد حراً في الطبيعة.
الفضة.
ز- أتوقع: أي هذه الفلزات يمكنه أن يحل محل الحديد في مركباته، ولا يمكنه أن يحل محل المغنيسيوم في مركباته.
الخارصين.
إعداد : شبكة منهاجي التعليمية
15 / 02 / 2025
النقاشات
يزيد النويديس
شكرا
إضافة رد
0 ردود
Esraa Alkilani
شكرا
إضافة رد
0 ردود
Walaa Dalalah
شكرا لكم
إضافة رد
0 ردود