التأين الذاتي للماء
Autoionization of Water
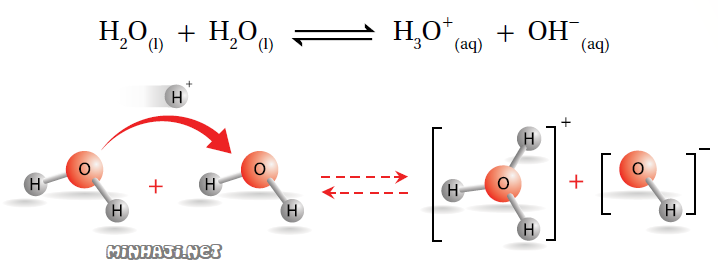
يوصف لماء النقي بأنه غير للتيار الكهربائي، إلا أن القياسات تشير إلى أن الماء النقي موصل بدرجة ضئيلة جداً، وهذا يعود إلى أنه يمكن لجزيء الماء أن يتصرف كحمض ويمنح بروتوناً لجزيء ماء آخر فيتكون أيون H3O+ ، ويتصرف جزيء ماء آخر كقاعدة ويستقبل بروتوناً فيتكون أيون OH- .
وجود أيونات H3O+ و OH- في الماء النقي يجعله موصلاً ضعيفاً للتيار الكهربائي، وهذا السلوك للماء يعرف بالتأين الذاتي للماء.
التأين الذاتي للماء: سلوك بعض جزيئات الماء كحموض وبعضها الآخر كقواعد في الماء نفسه.
يعبر عن ثابت الاتزان (KC) للتأين الذاتي للماء كالتالي:
Kc = =
ونظراً لأن الماء يتأين بدرجة ضئيلة جداً فإن تركيزه يعد ثابتاً، ويمكن دمجه بثابت الاتزان KC في ثابت جديد يسمى ثابت تأين الماء Kw .
Kw = [H3O+] [OH-] = 1 x 10-14
تستخدم العلاقة السابقة لحساب تركيز أيون الهيدرونيوم أو أيون الهيدروكسيد في الماء أو أي محلول آخر حمضي أو قاعدي أو متعادل.
ومن العلاقة السابقة نستنتج أن العلاقة بين تركيز أيون الهيدرونيوم وتركيز أيون الهيدروكسيد في أي محلول هي علاقة عكسية.
[H3O+] و [OH-] في الماء النقي
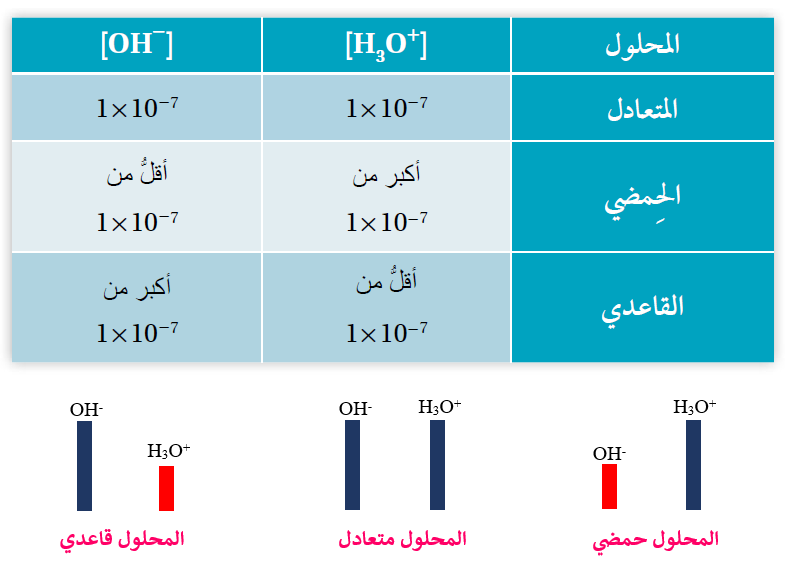
إن التأين الذاتي للماء يعطي تراكيز متساوية من أيونات H3O+ ، OH- .
Kw = [H3O+]2 = [OH-]2 = 1 x 10-14
وبأخذ جذر الطرفين:
[H3O+] = [OH-] = 1 x 10-7 M
أثر إضافة حمض أو قاعدة للماء النقي
إضافة حمض إلى الماء يزيد من [H3O+] ويقلل من [OH-] مع بقاء قيمة Kw ثابتة.
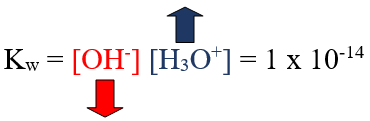
وفي هذه الحالة يكون المحلول حمضياً لأن [H3O+] > 1 x 10-7M
وكلما زاد [H3O+] زادت حمضية المحلول الحمضي.
إضافة قاعدة إلى الماء يزيد من [OH-] ويقلل من [H3O+] مع بقاء قيمة Kw ثابتة.
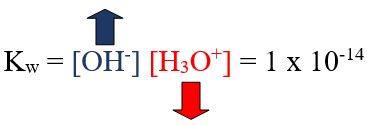
وفي هذه الحالة يكون المحلول قاعدياً لأن [OH-] > 1 x 10-7M
وكلما زاد [OH-] زادت قاعدية المحلول القاعدي.
تصنيف المحاليل تبعاً لتركيز أيونات H3O+ و OH-
مثال (1):
أحسب تركيز H3O+ في محلول يحتوي على أيونات OH- تركيزها 1 x 10-3 M ، وأبيّن ما إذا كان المحلول حمضياً أم قاعدياً أم متعادلاً. علماً أن (Kw = 1 x 10-14)
الحل:
[OH-] [H3O+] = 1 x 10-14 Kw =
[H3O+] = = = 1 x 10-11 M
المحلول قاعدي؛ لأن [H3O+] > [OH-] ، أو لأن [OH-] أكبر من 1 x 10-7 M
مثال (2):
أحسب [OH-] في محلول يبلغ [H3O+] فيه 1 x 10-9 M ، وأبيّن ما إذا كان المحلول حمضياً أم قاعدياً أم متعادلاً. علماً أن (Kw = 1 x 10-14)
الحل:
[OH-] [H3O+] = 1 x 10-14 Kw =
[OH-] = = = 1 x 10-5 M
المحلول قاعدي؛ لأن [OH-] < [H3O+] ، أو لأن [OH-] أعلى من 1 x 10-7 M
سؤال (1):
أكمل الفراغات في الجدول التالي وأصنف المحاليل إلى حمضية أم قاعدية أم متعادلة: (Kw = 1 x 10-14)
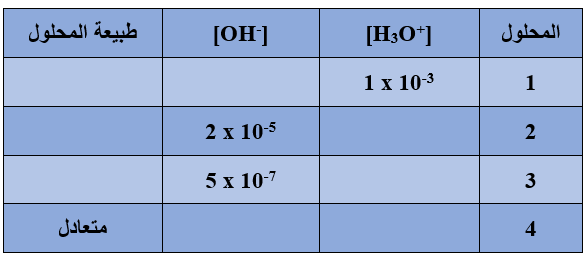
سؤال (2):
يبين الجدول أدناه تركيز H3O+ و تركيز OH- في محاليل حموض وقواعد افتراضية متساوية التركيز.
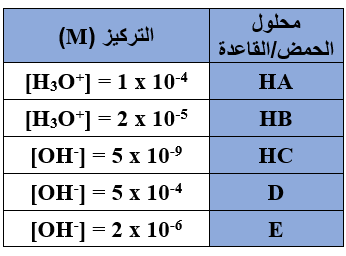
1- أي المحاليل يعتبر محلولاً لحمض؟
2- أي المحاليل يعتبر محلولاً لقاعدة؟
3- أحدد صيغة المحلول الأكثر حمضية.
4- أحدد صيغة المحلول الأكثر قاعدية.
5- أكتب معادلة تفاعل أقوى الحموض مع أضعف القواعد وفق تعريف برونستد - لوري.
في الملفات المرفقة أسئلة موضوعية على درس التأين الذاتي للماء مع إجاباتها.
في الملفات المرفقة إجابات أسئلة درس التأين الذاتي للماء.
إعداد : شبكة منهاجي التعليمية
31 / 01 / 2023
النقاشات