نظرية رابطة التكافؤ
Valence Bond Theory
تمكنت نظرية تنافر أزواج إلكترونات مستوى التكافؤ من تفسير أشكال الجزيئات، ولكنها لم توضح كيفية توزع إلكترونات الرابطة في الأفلاك، ومن أهم النظريات التي وضحت ذلك نظرية رابطة التكافؤ.
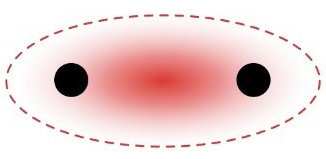
تتكون الرابطة التساهمية بين الذرتين تبعاً لنظرية رابطة التكافؤ عندما يتداخل فلك تكافؤ إحداهما مع فلك تكافؤ الأخرى في المنطقة الفراغية المحيطة بكل منهما تسمى الكثافة الإلكترونية، وهي منطقة لا تتسع لأكثر من إلكترونين، وينجذب فيها الإلكترونان نحو نواتي الذرتين في الوقت نفسه.
تفترض نظرية رابطة التكافؤ تكون نوعين من الروابط التساهمية بين أفلاك تكافؤ الذرتين المتداخلتين، هما:
- رابطة سيغما، وهي رابطة قوية تنشأ عند تداخل فلكين من ذرتين تداخلاً رأسياً، وتتركز كثافة الإلكترونات على امتداد المحور الواصل بين نواتي الذرتين.
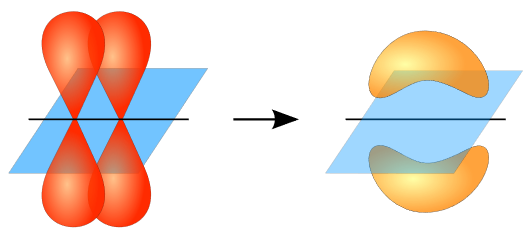
- رابطة باي، وهي رابطة ضعيفة تنشأ عندما يتداخل فلكين من ذرتين تداخلاً جانبياً، على جانبي المحور الواصل بين الذرتين.
تفسير تكون روابط تساهمية في الجزيئات البسيطة
يمكن استخدام هذه النظرية في تفسير بعض الجزيئات البسيطة ثنائية الذرة مثل: H2 , O2 , N2 , HCl
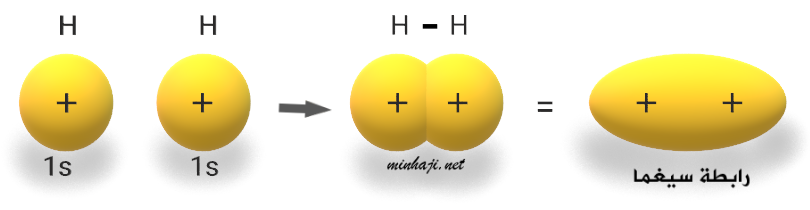
جزيء الهيدروجين H2
تحتوي كل ذرة هيدروجين على إلكترون منفرد.

عند اقتراب فلكين ذريين نصف ممتلئين من نوع 1s من ذرتي هيدروجين تتشكل رابطة تساهمية أحادية، ومن المتوقع أن يتواجد الإلكترونين في المنطقة بين النواتين، إذ يخضع كل منهما لقوة جذب نواتين في آن واحد، لذلك تزداد الكثافة الإلكترونية بين النواتين على طول المحور الواصل بين نواتي الذرتين المرتبطتين، وتتكون رابطة تساهمية قوية من نوع (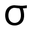 ).
).
جزيء كلوريد الهيدروجين HCl
تحتوي ذرة الهيدروجين على إلكترون منفرد، وتحتوي ذرة الكلور على إلكترون منفرد.
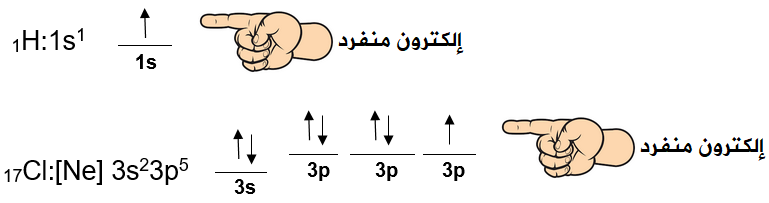
عند تداخل فلك ذري نصف ممتليء من نوع 3p من ذرة كلور مع فلك ذري من نوع 1s من ذرة الهيدروجين تتشكل رابطة تساهمية أحادية.
وفي هذا التداخل تتركز الكثافة الإلكترونية في المنطقة بين النواتين، وتتركز على طول المحور الواصل بين النواتين، وتكون الرابطة التساهمية في هذه الحالة من نوع سيغما (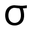 ).
).

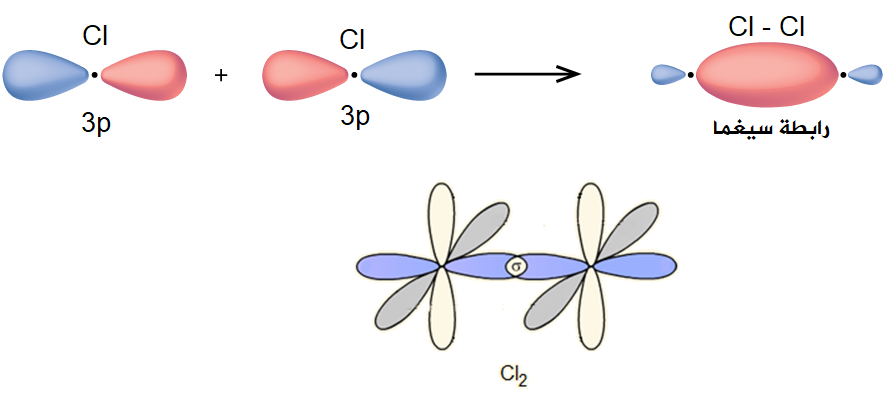
جزيء الكلور Cl2
تحتوي كل ذرة كلور على إلكترون منفرد.
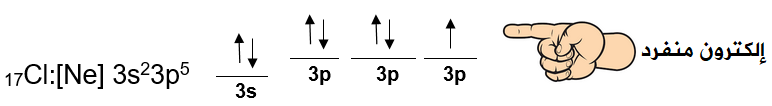
عند اقتراب فلكين ذريين نصف ممتلئين من نوع 3p من ذرتي كلور، تتشكل رابطة تساهمية أحادية، وبما أن الرابطة التساهمية أحادية فإنه من المتوقع حدوث تداخل رأسي بين فلكي p من الذرتين.
وفي هذا التداخل تتركز الكثافة الإلكترونية في المنطقة بين النواتين على طول المحور الواصل بين النواتين، وتكون الرابطة التساهمية في هذه الحالة من نوع سيغما (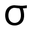 ).
).
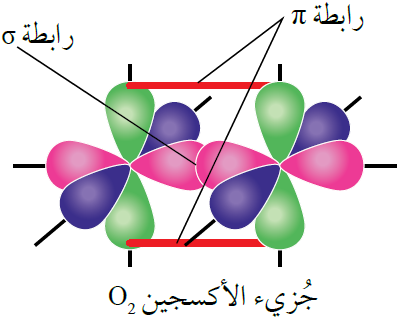
جزيء الأكسجين O2
تحتوي كل ذرة أكسجين على إلكترونين منفردين.
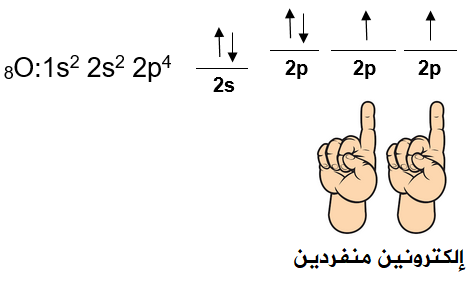
يتداخل فلكين ذريين نصف ممتلئين من نوع 2p بين ذرتي الأكسجين، وينشأ عن ذلك رابطتين تساهميتين، إحداها من نوع سيغما (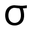 ) ناتجة عن تداخل رأسي بين فلكين متماثلين ونصف ممتلئين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية بين النواتين على طول المحور الواصل بين النواتين.
) ناتجة عن تداخل رأسي بين فلكين متماثلين ونصف ممتلئين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية بين النواتين على طول المحور الواصل بين النواتين.
كما تتكون رابطة تساهمية من نوع باي (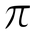 ) من التداخل الجانبي لفلكي 2p الآخرين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية في كلتا الرابطتين في منطقتين على جانبي الخط الواصل بين النواتين، لذا فإن هذا التداخل أضعف من التداخل سيغما (
) من التداخل الجانبي لفلكي 2p الآخرين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية في كلتا الرابطتين في منطقتين على جانبي الخط الواصل بين النواتين، لذا فإن هذا التداخل أضعف من التداخل سيغما (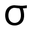 ).
).
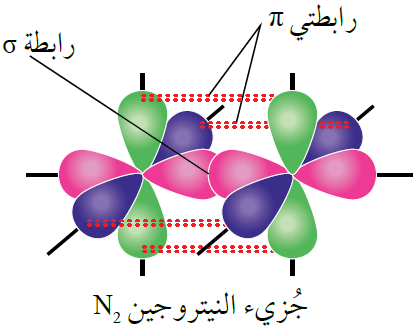
جزيء النيتروجين N2
تحتوي كل ذرة نيتروجين على (3) إلكترونات منفردة.
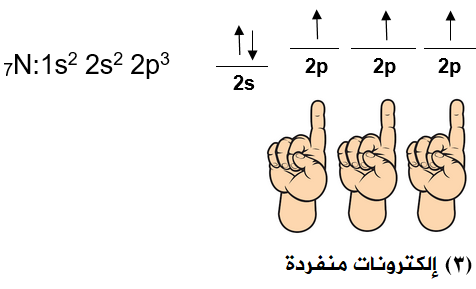
تتداخل ثلاثة أفلاك ذرية نصف ممتلئة من نوع 2p بين ذرتي النيتروجين، وينشأ عن ذلك ثلاث روابط تساهمية، إحداها من نوع سيغما (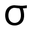 ) ناتجة عن تداخل رأسي بين فلكين متماثلين ونصف ممتلئين من كلتا الذرتين وتتوزع الكثافة الإلكترونية بين النواتين على طول المحور الواصل بين النواتين.
) ناتجة عن تداخل رأسي بين فلكين متماثلين ونصف ممتلئين من كلتا الذرتين وتتوزع الكثافة الإلكترونية بين النواتين على طول المحور الواصل بين النواتين.
كما تتكون رابطتين من نوع باي (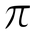 ) تتشكلان من التداخل الجانبي لفلكي 2p الآخرين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية في كلتا الرابطتين في منطقتين على جانبي الخط الواصل بين النواتين.
) تتشكلان من التداخل الجانبي لفلكي 2p الآخرين من كلتا الذرتين، وتتوزع الكثافة الإلكترونية في كلتا الرابطتين في منطقتين على جانبي الخط الواصل بين النواتين.
إعداد : أ. أحمد الحسين
24 / 09 / 2021
النقاشات