تحديد رتبة التفاعل من السرعة الابتدائية
تحدد سرعة التفاعل من خلال ملاحظة العلاقة بين تضاعف تركيز المادة المتفاعلة وتضاعف السرعة الابتدائية.
سؤال 1 :
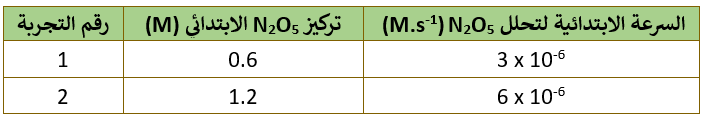
الجدول التالي يمثل تغير التركيز للتفاعل: 2N2O5(g) → 4NO2(g) + O2(g) في تجربتين مختلفتين.
1- أكتب قانون السرعة العام.
R = k [N2O5]X
2- أحدد رتبة التفاعل.
أقارن تركيز N2O5 في التجربتين (1) و (2)، حيث ألاحظ أن تركيز N2O5 تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة مرتين:
= 2
فالتفاعل من الرتبة الأولى (1).
3- أكتب قانون السرعة.
يكتب قانون السرعة بعد تحديد قيمة الرتبة كالآتي:
R = k [N2O5]1
4- أحسب قيمة ثابت سرعة التفاعل k .
لحساب ثابت سرعة التفاعل k نعوض التركيز والسرعة لأي من التجربتين الواردتين في الجدول في قانون السرعة، فمثلاً يمكن تعويض القيم الخاصة بالتجربة الأولى على النحو التالي:
R = k [N2O5]1
3 x 10-6 = k [6 x 10-1]1
k = 5 x 10-6 s-1
5- أحسب سرعة التفاعل عندما يكون تركيز N2O5 يساوي 1.5 x 10-3 M
نعوض التركيز المعطى في السؤال في قانون السرعة كالآتي:
R = k [N2O5]1
R = 5 x 10-6 x 1.5 x 10-3 = 7.5 x 10-9 M.s-1
6- إذا تضاعف [N2O5] أربع مرات، فكم تتضاعف سرعة التفاعل؟
بما أن التفاعل من الرتبة الأولى، لذا فإن مضاعفة [N2O5] (4) مرات سيضاعف سرعة التفاعل (4) مرات.
سؤال 2 :
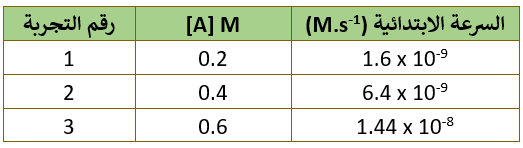
في التفاعل الافتراضي الآتي: A → B . تم جمع البيانات في الجدول الآتي:
1- ما رتبة التفاعل بالنسبة للمادة A ؟
أقارن تركيز A في التجربتين (1) و (2)، حيث ألاحظ أن تركيز A تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة (4) مرتين:
= 4
فالتفاعل من الرتبة الثانية (2).
2- أكتب قانون سرعة التفاعل.
يكتب قانون السرعة بعد تحديد قيمة الرتبة كالآتي:
R = k [A]2
3- أحسب قيمة k ، مع ذكر وحدته.
لحساب ثابت سرعة التفاعل k نعوض التركيز والسرعة لأي من التجارب الواردة في الجدول في قانون السرعة، فمثلاً يمكن تعويض القيم الخاصة بالتجربة الأولى على النحو التالي:
R = k [A]2
1.6 x 10-9 = k [2 x 10-1]2
k = 4 x 10-8 M.s
4- أحسب سرعة التفاعل إذا كان = 0.03 M [A]
نعوض التركيز المعطى في السؤال في قانون السرعة كالآتي:
R = k [A]2
R = 4 x 10-8 x (3 x 10-2)2 = 3.6 x 10-11 M.s-1
سؤال 3 :
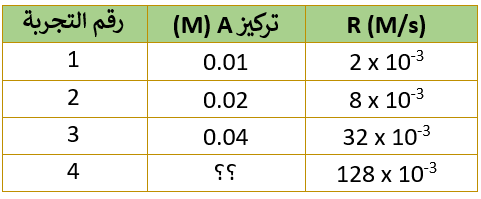
الجدول التالي يمثل تغير التركيز للتفاعل: 2A → B + 3C
1- ما رتبة التفاعل السابق؟
أقارن تركيز A في التجربتين (1) و (2)، حيث ألاحظ أن تركيز A تضاعف مرتين:
= 2
وفي المقابل تضاعفت السرعة (4) مرات:
= 4
فالتفاعل من الرتبة الثانية (2).
2- أكتب قانون سرعة التفاعل.
يكتب قانون السرعة بعد تحديد قيمة الرتبة كالآتي:
R = k [A]2
3- أحسب قيمة ثابت السرعة k مع ذكر وحدته.
لحساب ثابت سرعة التفاعل k نعوض التركيز والسرعة لأي من التجارب الواردة في الجدول في قانون السرعة، فمثلاً يمكن تعويض القيم الخاصة بالتجربة الأولى على النحو التالي:
R = k [A]2
2 x 10-3 = k [1 x 10-2]2
k = 20 M.s
4- أحسب سرعة التفاعل عندما يكون [A] = 0.5 M
نعوض التركيز المعطى في السؤال في قانون السرعة كالآتي:
R = k [A]2
R = 20 x (0.5)2 = 20 x 0.25 = 5 M.s-1
5- كم تتضاعف سرعة التفاعل إذا تضاعف [A] 4 مرات؟
بما أن التفاعل من الرتبة الثانية، لذا فإن مضاعفة [A] (4) مرات سيضاعف سرعة التفاعل (16) مرّة.
6- كم يبلغ [A] في التجربة رقم (4)؟
أقارن سرعة التفاعل في التجربتين (3) و (4)، حيث ألاحظ أن السرعة تضاعفت (4) مرات، وبما أن التفاعل من الرتبة الثانية؛ إذن يجب أن يتضاعف تركيز المادة A مرتين، وعليه فإن تركيز A يساوي 0.08M
ويمكن حساب تركيز A من خلال تعويض معطيات التجربة رقم (4)، وتعويض قيمة ثابت السرعة المحسوب في الفرع (3) في قانون السرعة.
إعداد : شبكة منهاجي التعليمية
22 / 06 / 2023
النقاشات