نظرية التصادم وسرعة التفاعلات

وضعت نظرية التصادم من قبل العالمين ماكس تراوتز ووليام لويس:
- لتفسير كيفية حدوث التفاعلات الكيميائية وتفاوت سرعاتها.
- قدمت اقتراحات حول كيفية تغيير سرعة التفاعل الكيميائي.
افتراضات نظرية التصادم:
الافتراض الأول:
لحدوث التفاعل الكيميائي يجب تصادم جسيمات المواد المتفاعلة معاً.
الافتراض الثاني:
يجب أن تكون طاقة التصادم كافية لتكسير الروابط بين الجسيمات المتفاعلة وتكوين روابط جديدة.
الافتراض الثالث:
يجب أن يكون التصادم بين جسيمات المتفاعلات فعالاً كي يحدث التفاعل.
التصادم الفعال: التصادم الذي يمتلك طاقة كافية ويؤدي إلى حودث التفاعل وتكوين نواتج.
وحتى يكون التصادم فعالاً لا بد من شرطين، هما:
1- أن يكون تصادم الجسيمات المتفاعلة في الاتجاه الصحيح (الاتجاه المناسب).
2- توفر الحد الأدنى من الطاقة اللازمة لبدء التفاعل والتي تسمى طاقة التنشيط (Ea).
توضيح مفهوم اتجاه التصادم الصحيح (المناسب):
مثال (1):
تفاعل أحادي أكسيد النيتروجين مع الكلور:
NO(g) + Cl2(g) → NOCl(g) + Cl(g)
هنالك احتمالان للتصادم:
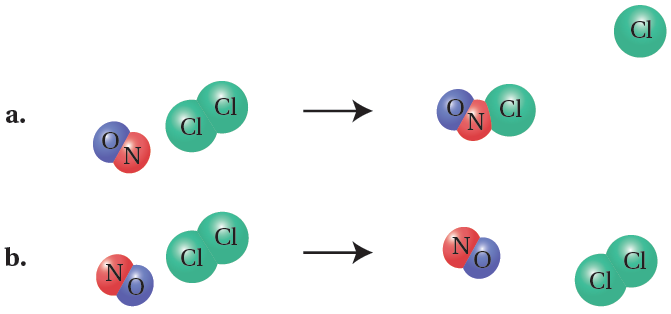
- الاحتمال (a) أدى إلى تكوين نواتج جديدة؛ لذا يمكن اعتبار اتجاه التصادم صحيحاً، ولا يمكن اعتبار التصادم فعالاً إلا إذا توفر فيه الحد الأدنى من الطاقة اللازمة لتكسير الروابط.
- الاحتمال (b) لم يؤدِ إلى تكوين نواتج جديدة؛ لذا يمكن اعتبار اتجاه التصادم غير صحيح، وسترتد الجسيمات بعضها عن بعض عند تصادمها.
مثال(2):
انظر إلى التفاعل التالي:
A2 + B2 → 2AB
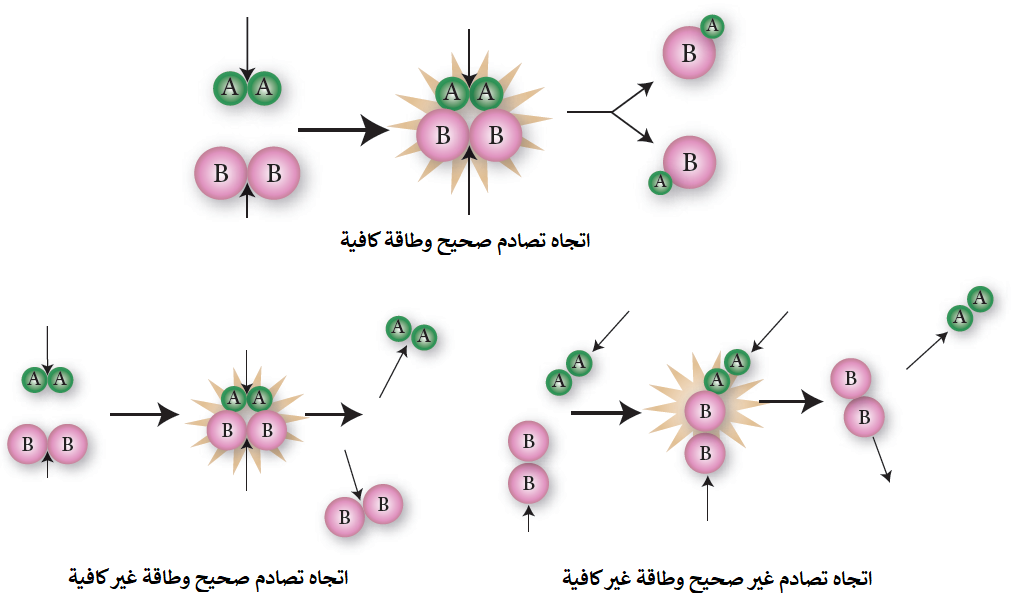
سؤال 1 :
أستنتج من الشكل الآتي أي الاحتمالين يعدّ اتجاهاً صحيحاً للتصادم الفعال بين جزيئات أحادي أكسيد النيتروجين وجزيئات الأوزون؛ وفق المعادلة الآتية:
NO + O3 → NO2 + O2
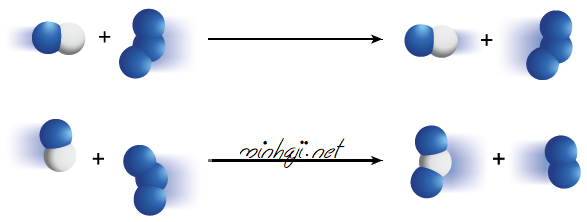
الاحتمال الثاني؛ لأنه أدى إلى تكوين نواتج جديدة.
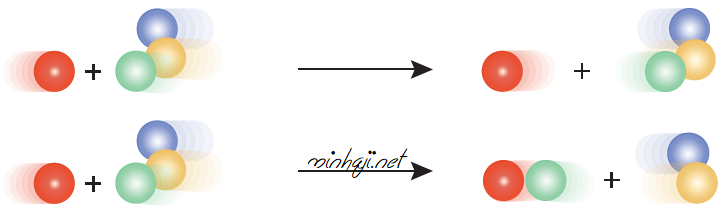
سؤال 2 :
بالاعتماد على شرطي التصادم الفعال؛ أستنتج من الشكل الافتراضي الآتي أي الحالتين تمثل تصادماً فعالاً، وأيهما تمثل تصادماً غير فعال، وأفسر إجابتي.
توضيح مفهوم المعقد المنشط
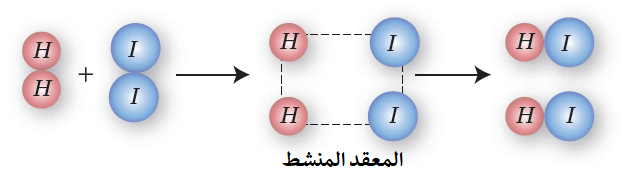
 وعندما تكتسب المتفاعلات حد أدنى من الطاقة لكسر الروابط يتكون بناء غير مستقر يسمى المعقد المنشط.
وعندما تكتسب المتفاعلات حد أدنى من الطاقة لكسر الروابط يتكون بناء غير مستقر يسمى المعقد المنشط.
المعقد المنشط: حالة انتقالية غير مستقرة من تجمع الذرات، يبدأ فيها تكسير الروابط وتكوين روابط جديدة وتمتلك أعلى طاقة؛ يطلق عليها طاقة المعقد المنشط (HC).
مثال:
المعقد المنشط الذي يتكون من تفاعل الهيدروجين مع اليود:
H2 + I2 → 2HI
سؤال 3 :
إذا كان لديك التفاعل العام التالي:
2AB → A2 + B2
1- أرسم التوجه المناسب لتفاعل تفكك AB .
2- أرسم التوجه المناسب لتفاعل تكوّن AB .
3- أرسم المعقد المنشط.
توضيح مفهوم طاقة التنشيط
طاقة التنشيط: الحد الأدنى من الطاقة اللازمة لكسر الروابط بين ذرات المواد المتفاعلة، وتكوين روابط جديدة.
وكلما زادت طاقة التنشيط قلت سرعة التفاعل.
تفسير أثر طاقة التنشيط بيانياً:
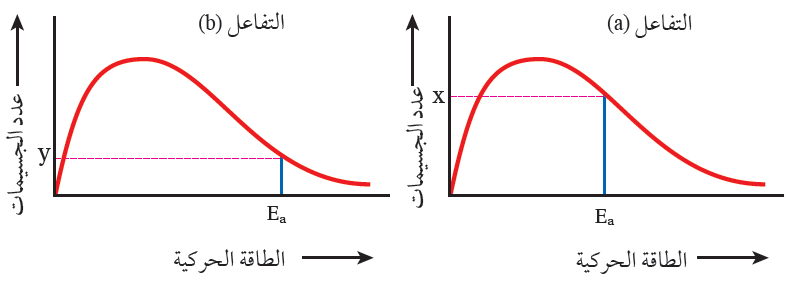
التفاعل الذي يمتلك طاقة تنشيط منخفضة (a) يكون عدد الجسيمات التي تمتلك طاقة تنشيط كبيراً، فيزداد احتمال تكوين المعقد المنشط عند تصادمها بالاتجاه الصحيح، فتزداد سرعة التفاعل.
إعداد : أ. أحمد الحسين
24 / 01 / 2023
النقاشات