حساب سرعة التفاعل
من خلال الشكل البياني الآتي، لاحظ ما يحدث لتراكيز المواد المتفاعلة، ولتراكيز المواد الناتجة بمرور الزمن:
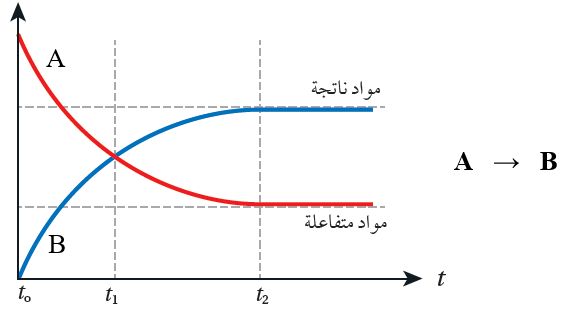
- تقل تراكيز المواد المتفاعلة بمرور الزمن، وعند زمن معين (t2) تثبت التراكيز.
- تزداد تراكيز المواد الناتجة بمرور الزمن، وعند زمن معين (t2) تثبت التراكيز.
- عندما تثبت تراكيز المتفاعلات أو النواتج نصل إلى نقطة نهاية التفاعل؛ وإذا كان التفاعل متزناً يكون التفاعل قد وصل إلى حالة الاتزان.
- سرعة التفاعل في بداية التفاعل تكون أعلى ما يمكن لأن التغير في التركيز كبيراً.
- تقل سرعة التفاعل مع مرور الزمن؛ لأن التغير في التركيز يقل مع مرور الزمن.
- تحسب سرعة التفاعل بدلالة النقصان في تركيز إحدى المواد المتفاعلة، أو زيادة تركيز إحدى المواد الناتجة خلال مدة زمنية محددة.
وعليه إذا قيست سرعة التفاعل بدلالة إحدى المواد المتفاعلة في الفترة الزمنية (t1 – t2) يلاحظ أن التركيز يقل، وعليه سيكون التغير في التركيز سالباً؛ لذا نضع إشارة (-) في العلاقة الرياضية المستخدمة لحساب سرعة استهلاك المادة المتفاعلة:
R = - = -
وإذا قيست سرعة التفاعل بدلالة إحدى المواد الناتجة في الفترة الزمنية (t1 – t2) يلاحظ أن التركيز يزداد، وعليه سيكون التغير في التركيز موجباً؛ لذا تكون العلاقة الرياضية المستخدمة لحساب سرعة إنتاج المادة الناتجة:
R = =
وتكون وحدة سرعة التفاعل: (M/s) or (M.s-1) or (mol/L.s)
سؤال 1 :
أنظر إلى الجدول أدناه والمتعلق بالتفاعل التالي، ثم أجيب عن الأسئلة التي تليه:
A + B → C + D
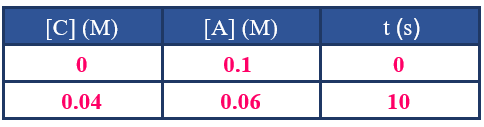
1- كيف أعرف من جدول البيانات أن المادة A مادة متفاعلة؟
2- كيف أعرف من جدول البيانات أن المادة C مادة ناتجة؟
3- أحسب سرعة تكوين C في الفترة الزمنية من بداية التفاعل إلى الزمن (10 s).
4- أحسب سرعة استهلاك A في الفترة الزمنية من بداية التفاعل إلى الزمن (10 s).
5- ماذا أستنتج من إجابة السؤالين السابقين؟ ولماذا؟
6- أحسب سرعة تكوين D في الفترة الزمنية نفسها.
الحل:
1- تركيزها يقل بمرور الزمن.
2- تركيزها يزداد بمرور الزمن.
3- أقسم التغير في تركيز C على التغير في الزمن:
R = = = = 0.004 M/s
4- أقسم التغير في تركيز A على التغير في الزمن:
R = - = - = = 0.004 M/s
5- سرعة استهلاك A = سرعة تكوين C ؛ لأن عدد مولات كل منهما متساوٍ في المعادلة الموزونة.
6- بما أن عدد مولات D في المعادلة الموزونة = عدد مولات C ؛ إذن سرعة تكوين D = 0.004 M/s
سؤال 2 :
يبين الجدول الآتي تركيز المادة E مقابل الزمن.
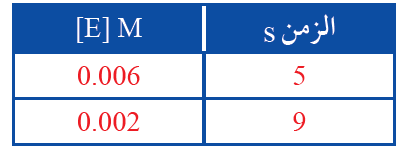
1- أتوقع: هل المادة E متفاعلة أم ناتجة؟ أفسر ذلك.
2- أحسب سرعة التفاعل.
الحل:
1- المادة E مادة متفاعلة؛ لأن تركيزها يقل بمرور الزمن.
2- أطبق العلاقة:
R = - = - = = 0.001 M/s
سؤال 3 :
في التفاعل الآتي: CO + NO2 → NO + CO2
إذا كان تركيز NO يساوي 0.40 M بعد مرور 45 s على بدء التفاعل، ويساوي 0.75 M بعد مرور 80 s على بدئه:
1- أحسب سرعة تكوين NO في الفترة (45 – 80 s).
2- أحسب سرعة استهلاك CO في الفترة (45 – 80 s).
3- أحسب سرعة استهلاك CO إذا كان تركيزه في بداية التفاعل 1.8 x 10-3 M ثم أصبح 1.2 x 10-3 M بعد زمن 20 s .
الحل:
1- أقسم التغير في تركيز NO على التغير في الزمن:
R = = = = 0.01 M/s
2- سرعة استهلاك CO = سرعة تكوين NO = 0.01 M/s؛ لأن عدد المولات متساوٍ.
3- أقسم التغير في تركيز CO على التغير في الزمن:
R = - = - = = 3 x 10-5 M/s
سؤال 4 :
الجدول الآتي فيه معلومات للتفاعل الافتراضي: B A → عند درجة حرارة معينة، أدرسه ثم أجيب عن الأسئلة التي تليه:
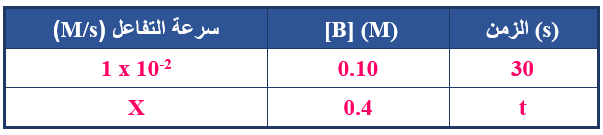
1- هل قيمة الزمن (t) أكبر أم أقل أم تساوي (30 s)؟
2- هل قيمة (X) أكبر أم أقل أم تساوي (1 x 10-2)؟
الحل:
1- الزمن (t) أكبر من (30 s).
2- قيمة (X) أقل من (1 x 10-2).
إعداد : أ. أحمد الحسين
07 / 02 / 2023
النقاشات