مفهوم لويس
Lewis Concept
الحمض: مادة يمكنها استقبال زوج أو أكثر من الإلكترونات في أثناء التفاعل.
شروط حمض لويس: يجب أن يحتوي الحمض على أفلاك فارغة ولا يشترط توفر الهيدروجين.
القاعدة: مادة يمكنها منح زوج أو أكثر من الإلكترونات في أثناء التفاعل.
شروط قاعدة لويس: يجب أن تحتوي القاعدة على أزواج من الإلكترونات غير الرابطة.
وعند منح القاعدة لزوج الإلكترونات غير الرابطة تنشأ رابطة تناسقية بين الحمض والقاعدة.

أهمية تعريف لويس:
- فسر لويس سلوك الحموض والقواعد التي فسرها برونستد - لوري.
- فسر لويس سلوك الحموض والقواعد التي لم يفسرها برونستد - لوري، كمركبات البورون مثل BF3 وأيونات الفلزات التي تكون أيونات معقدة.
مثال (1):
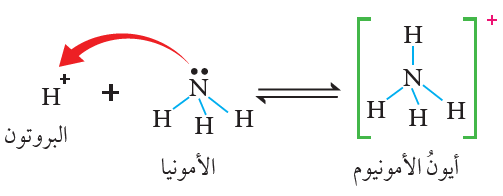
تُعد NH3 قاعدةً حسب تعريف برونستد - لوري؛ لأن لها القدرة على استقبال بروتون من مادة أخرى كحمض HCl ، ويسلك HCl سلوك الحمض لأن له القدرة على منح بروتون للقاعدة.
تُعد NH3 قاعدةً حسب تعريف لويس لاحتوائها على زوج غير رابط من الإلكترونات تستطيع أن تمنحه للبروتون الناتج عن تأين الحمض HCl ، الذي يمتلك فلكاً فارغاً فعند انتقال البروتون إلى الأمونيا فإنه يستقبل زوج إلكترونات غير رابط من ذرة النيتروجين، ويرتبط به، فتنشأ رابطة تناسقية، ويتكون أيون الأمونيوم NH4+ .
مثال (2):
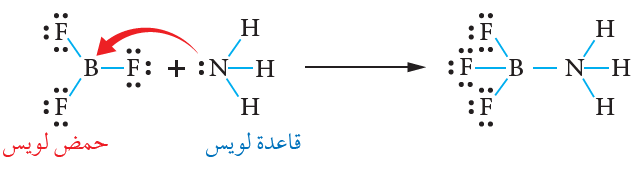
فسر لويس تفاعل الأمونيا NH3 مع ثلاثي فلوريد البورون BF3 ، وهو تفاعل لا ينطبق على مفهوم برونستد - لوري، فالبورون يحتوي على فلك فارغ، يمكنه استقبال زوج من الإلكترونات غير رابط من الأمونيا، وتتكون بينهما رابطة تناسقية، ويسلك بذلك البورون كحمض، وتسلك الأمونيا كقاعدة.
ثلاثي فلوريد البورون BF3 غاز سام عديم اللون، يستخدم في تحفيز العديد من التفاعلات كتفاعلات البلمرة.
يحضر فلوريد البورون بتسخين البورون مع معدن الفلوريت CaF2 بوجود حمض الكبريتيك.
مثال (3):
فسر لويس تكوين الأيونات المعقدة التي تنتج من تفاعل أيونات بعض الفلزات الموجبة والتي تحتوي على أفلاك فارغة مع جزيئات مثل H2O أو NH3 أو أيونات أخرى مثل CN- فيتكون أيون معقد.
فمثلاً يتفاعل أيون النحاس Cu2+ مع الماء وفق المعادلة الآتية:
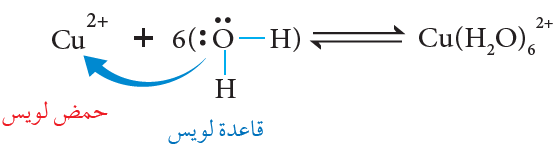
يقدم الماء زوج من الإلكترونات ويقدم أيون النحاس فلكاً فارغاً ويتكون بينهما رابطة تناسقية.
وبالطريقة نفسها يمكن تفسير تفاعل أيون الفضة Ag+ مع أيونات السيانيد CN- ، وفق المعادلة:
Ag+(aq) + 2CN-(aq) Ag(CN)2-(aq)
يمتلك أيون الفضة أفلاكاً فارغة، وتمتلك أيونات السيانيد أزواج إلكترونات غير رابطة، يتصرف أيون السيانيد كقاعدة عندما يمنح كل أيون زوج غير رابط من الإلكترونات إلى الفلك الفارغ في أيون الفضة فيسلك بذلك أيون الفضة كحمض.
سؤال:
أحدد الحمض والقاعدة حسب مفهوم لويس في كل من التفاعلات الآتية:
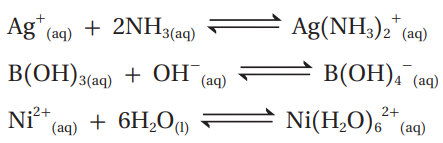
إعداد : أ. أحمد الحسين
14 / 08 / 2024
النقاشات