المادة المحددة للتفاعل
Limiting Reactant
هب أنك ترغب بإعداد شطائر الجبن لأصدقائك، وكانت كل شطيرة تحتاج إلى قطعتي خبز، وشريحة جبن.
فإذا كان لديك (28) قطعة خبز، و (11) شريحة جبن، فإنك بذلك تستطيع تحضير (11) شطيرة، ويتبقى لديك (6) قطعٍ من الخبز.
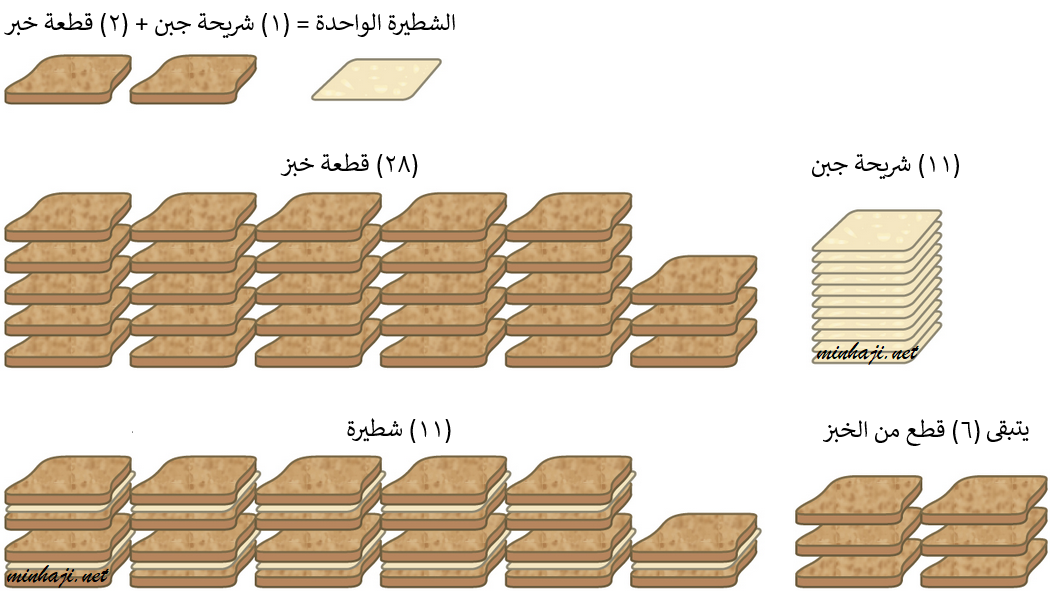
تُسمى شرائح الجبن المادة المحددة، لأنها استهلكت جميعها عند إعداد الشطائر، وتُسمى قطع الخبز المتبقية بعد إعداد الشطائر بالمادة الفائضة.
مفهوم المادة المحددة والمادة الفائضة
المادة المحددة للتفاعل: المادة التي تُستهلك كلياً في التفاعل وتحدد كمية الناتج المتكون.
المادة الفائضة: المادة التي لم تُستهلك كاملة في أثناء التفاعل.
مثال:
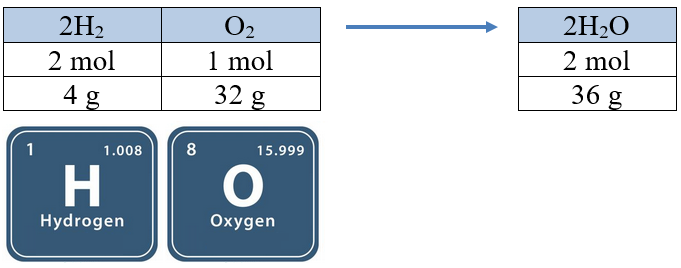
يتفاعل الهيدروجين مع الماء وفق المعادلة الآتية:
2H2 (g) + O2 (g) → 2H2O (g)
ومن خلال المعادلة يتبين أن:
- (1 mol) من غاز الأكسجين يحتاج إلى (2 mol) من غاز الهيدروجين، لإنتاج (2 mol) من بخار الماء.
- (32 g) من غاز الأكسجين يحتاج إلى (4 g) من غاز الهيدروجين، لإنتاج (36 g) من بخار الماء.
ولكن ماذا يحدث عند خلط كميات من المواد الهيدروجين والأكسجين بنسب مولات لا تتطابق مع نسب المولات في المعادلة الموزونة؟
إحدى المواد ستستهلك كلياً في التفاعل وتحدد كمية المادة الناتجة، وتسمى المادة المحددة للتفاعل، في حين تبقى مادة زائدة من المادة المتفاعلة الأخرى تسمى المادة الفائضة.
ففي المعادلة السابقة لو تم خلط (1 mol) من الأكسجين مع (5 mol) من الهيدروجين، سيُستهلك المول من الأكسجين كاملاً ويسمى المادة المحددة، وسيستهلك (2 mol) من الهيدروجين فقط، وستكون هنالك كمية فائضة من الهيدروجين مقدارها (3 mol)، ويسمى الهيدروجين بالمادة الفائضة.
إعداد : أ. أحمد الحسين
19 / 02 / 2022
النقاشات