الارتفاع في درجة الغليان
Boiling Point Elevation
يغلي السائل عندما يتساوى الضغط البخاري للسائل مع الضغط الجوي.
يبدأ الماء النقي بالغليان عند درجة حرارة 100 oC ، وتثبت درجة غليانه عند هذه الدرجة.
عند إذابة مادة غير متأينة أو متطايرة في الماء، فإن المحلول يغلي على درجة أعلى من 100 oC ، أي أن درجة غليان المحلول أعلى من درجة غليان الماء النقي؛ ويعود ذلك لسببين:
- تحتل دقائق المذاب جزءاً من سطح الماء (المذيب)، فيقل عدد جزيئات الماء عند السطح ويقل تبخرها، ويقل الضغط البخاري.
- نشوء تجاذب بين بعض جسيمات المذيب وجسيمات المذاب، وهذا يقلل عدد جسيمات المذيب التي يمكن أن تفلت من السطح لتتحول إلى الحالة الغازية، فيقل الضغط البخاري، مما يتطلب زيادة درجة الحرارة للتغلب على قوى التجاذب.
يُسمى الفرق بين درجة غليان المذيب النقي والمحلول الارتفاع في درجة الغليان.
- عند إذابة 1 mol من السكر (342 g) في 1 Kg من الماء يغلي المحلول عند درجة 100.52 oC.
- عند إذابة 1 mol من اليوريا (60 g) في 1 Kg من الماء يغلي المحلول عند درجة 100.52 oC.
وهذا يعني أن إذابة 1 mol من مادة غير متأينة وغير متطايرة في 1 Kg من الماء يرفع من درجة غليان الماء بمقدار (0.52 oC)، ويمثل هذا المقدار ثابت الارتفاع في درجة غليان الماء، وهو يتغير بتغير المذيب.
يتناسب الارتفاع في درجة غليان المحلول طردياً مع النسبة بين عدد جسيمات المذاب وجسيمات المذيب؛ أي تتناسب طردياً مع التركيز المولالي للمحلول.
ويعبر عنه بالصيغة الرياضية كما يأتي:
الارتفاع في درجة الغليان 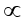 المولالية
المولالية
الارتفاع في درجة الغليان = ثابت × المولالية
Tb = Kb x m
حيث:
Tb: الارتفاع في درجة الغليان.
Kb: ثابت الارتفاع في درجة غليان المذيب.
m: التركيز المولالي للمحلول.
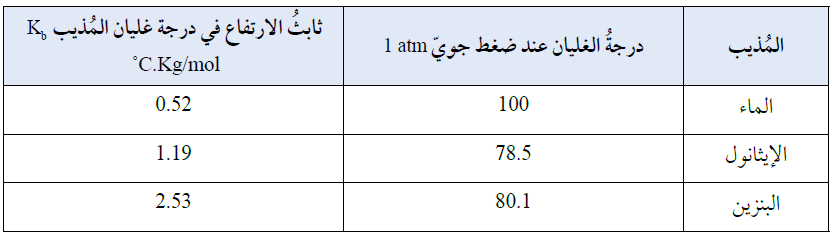
ويوضح الجدول أدناه قيم ثابت الارتفاع في درجة غليان بعض المذيبات:
يبدأ الماء النقي بالغليان عند درجة حرارة 100 oC ، وتثبت درجة غليانه عند هذه الدرجة، ولكن عند إذابة مادة غير متاينة أو متطايرة في الماء فإن درجة الغليان ترتفع، ولا تثبت أثناء الغليان؛ ويعود ذلك إلى أنّ عملية التبخر تؤدي إلى نقص في كمية المذيب في المحلول، فيزداد تركيزه بمرور الوقت، ويقل بذلك عدد جسيمات المذيب القادرة على الإفلات من سطح السائل، فيقل التبخر، والضغط البخاري، فتزداد درجة الغليان.
أما عند إذابة مادة متأينة (غير متطايرة) في الماء، فإن الارتفاع في درجة الغليان يزداد؛ لأن عدد الدقائق في محلول المادة المتأينة أكبر من عدد الدقائق في محلول المادة غير المتأينة.
لاحظ من المعادلتين الآتيتين أن عدد الدقائق في محلول NaCl (مادة متأينة) أكبر من عدد الدقائق في محلول السكر (مادة غير متأينة):
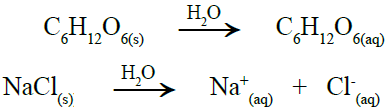
ويمكن ملاحظة ذلك من المنحنى الآتي الذي يمثل مقارنة بين درجة غليان الماء، ومحلول مادة غير متأينة، ومادة متأينة:
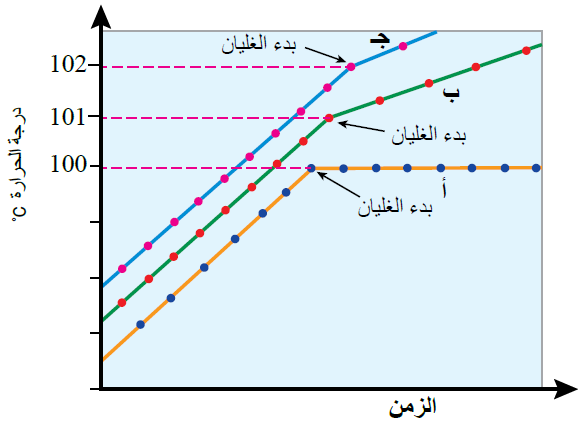
حيث:
المنحنى (أ) يمثل ماءً نقياً.
المنحنى (ب) يمثل محلول مادة غير متأينة.
المنحنى (ج) يمثل محلول مادة غير متأينة.
أمثلة محلولة
مثال (1):
أحسب درجة غليان محلول ناتج من إذابة 24.4 g من حمض البنزويك (كتلته المولية = 122 g/mol) في 500 g من الإيثانول، علمًا بأن درجة غليان الإيثانول 78 oC، وثابت الارتفاع في درجة غليان الإيثانول = 1.07 oC.Kg/mol.
تحليل السؤال (المعطيات)
كتلة المادة المذابة = 24.4 g
كتلة الماء النقي (المذيب) = 500 g = 0.5 Kg
ثابت الارتفاع في درجة غليان الإيثانول = 1.07 oC.Kg/mol
الكتلة المولية للمذاب Mr = 122 g/mol
الحل:
نحسب عدد مولات المذاب:
n = m / Mr = 24.4 g / 122 g/mol = 0.2 mol
نحسب التركيز المولالي:
m = n solute / solvent mass = 0.2 mol / 0.5 Kg = 0.4 molal
نحسب الارتفاع في درجة الغليان:
Tb = Kb x m = 1.07 x 0.4 = 0.428
درجة غليان المحلول 78 + 0.428 = 78.428 oC
مثال (2):
إذا علمت أن 5.85 g من أذيب في 0.5 Kg من الماء، فأحسب درجة غليان المحلول علماً بأن الكتلة المولية للمذاب = 58.5 g/mol ، وثابت الارتفاع في درجة غليان الماء = 0.52 oC.Kg/mol.
تحليل السؤال (المعطيات)
كتلة المادة المذابة = 5.85 g
كتلة الماء النقي (المذيب) = 0.5 Kg
ثابت الارتفاع في درجة غليان الماء = 0.52 oC.Kg/mol
الكتلة المولية للمذاب Mr = 58.5 g/mol
الحل:
نحسب عدد مولات المذاب:
n = m / Mr = 5.85 g / 58.5 g/mol = 0.1 mol
نحسب التركيز المولالي:
m = n solute / solvent mass = 0.1 mol / 0.5 Kg = 0.2 molal
ومن معادلة تفكك الملح في الماء نلاحظ أن عدد مولات الأيونات الناتجة = 2
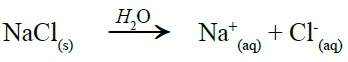
وعليه فإن التركيز المولالي = 0.2 x 2 = 0.4 molal
نحسب الارتفاع في درجة الغليان:
Tb = Kb x m = 0.52 x 0.4 = 0.208
درجة غليان المحلول 100 + 0.208 = 100.208 oC
تدريبات
تدريب (1):
عند إذابة 0.64 g من مادة عضوية غير متطايرة في 100 g من البنزين وجد أن درجة غليان المحلول 80.23 oC . احسب الكتلة المولية للمادة المذابة، علمًا بأن درجة غليان البنزين 80.1 oC ، وثابت الارتفاع في درجة غليان البنزين = 2.61 oC.Kg/mol.
تدريب (2):
احسب درجة غليان محلول ناتج من إذابة 18.4 g غليسرول في كيلوغرامين من الماء، علمًا بأن ثابت الارتفاع في درجة غليان للماء 0.52 oC.Kg/mol ، والكتلة المولية للغليسرول 92 g/mol.
الجواب النهائي: 100.052 oC
تدريب (3):
عند إذابة 2.25 g من مركب مجهول (غير أيوني) في (150 g) من سايكلوهكسان (مذيب عضوي) ارتفعت درجة غليانه 0.481 oC. أحسب الكتلة المولية للمركب، علماً بأن ثابت الارتفاع في درجة الغليان للمذيب يساوي 2.79 oC.Kg/mol.
تدريب (4):
أذيب 50 g من غلايكول الإيثلين C2H6O2 في 55 g من الماء. احسب درجة غليان المحلول الناتج، علمًا بأن ثابت الارتفاع في درجة غليان الماء = 0.52 oC.Kg/mol ، والكتلة المولية لغلايكول إثيلين 62 g/mol.
تدريب (5):
أذيب 7.45 g من كلوريد البوتاسيوم KCl في 360 g من الماء. أحسب درجة غليان المحلول، علمًا بأن وثابت الارتفاع في درجة غليان الماء = 0.52 oC.Kg/mol، والكتلة المولية لكلوريد البوتاسيوم 74.5 g/mol.
الجواب النهائي: 100.29 oC
تدريب (6):
أي المحلولين الآتيين له أعلى درجة غليان: Na2CO3 أم NaBr ، علمًا بأن تركيزهما المولالي متساوٍ، والضغط المؤثر فيهما هو نفسه (بافتراض التفكك التام لكلّ منهما)؟
اكتب معادلة تفكك K2SO4 إلى أيونات عند إذابته في الماء، ثم احسب التركيز الكلي للأيونات في محلول تركيزه 0.003 mol/Kg من K2SO4 ، مفترضًا التفكك التام للمحلول.
إعداد : أ. أحمد الحسين
21 / 01 / 2022
النقاشات