الرابطة التساهمية الثنائية
تنشأ الرابطة التساهمية الثنائية عندما تتشارك ذرتان بزوجين رابطين من الإلكترونات.
مثال (1):
أكتب تركيب لويس لجزيء O2 ، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة في الجزيء. (العدد الذري لذرة O = 8).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرة الأكسجين:

ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ O × عدد ذراته)
Total (v.e) = (6 x 2) = 12e-
ثالثاً: أحسب عدد أزواج الإلكترونات الكلي (v.e.p):
n(v.e.p) = = 6
رابعاً: أرسم رابطة أحادية بين ذرتي الأكسجين:

خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 6 – 1 = 5
سادساً: أوزع الأزواج المتبقية على ذرتي الأكسجين:
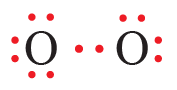
لاحظ أن قاعدة الثمانية تحققت لإحدى ذرتي الأكسجين ولم تحقق للذرة الثانية؛ لذا نحول أحد الأزواج غير الرابطة إلى زوج رابط من الإلكترونات.
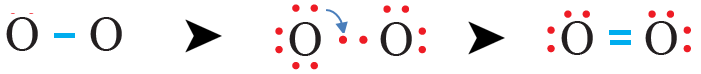
- عدد أزواج الإلكترونات الرابطة: (2) زوج.
- عدد أزواج الإلكترونات غير الرابطة على كل ذرة أكسجين: (2) زوج.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء: (4) أزواج.
مثال (2):
أكتب تركيب لويس لجزيء ثاني أكسيد الكربون CO2 ، وأحدد عدد أزواج الإلكترونات الرابطة وغير الرابطة في الجزيء. (العدد الذري لذرة C = 6 ، وللذرة O = 8).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الجزيء:

ثانياً: أحسب عدد إلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ C × عدد ذراته) + (عدد إلكترونات تكافؤ O × عدد ذراته)
Total (v.e) = (4 x 1) + (6 x 2) = 16e-
ثالثاً: أحسب عدد أزواج إلكترونات التكافؤ (v.e.p):
n(v.e.p) = = 8
رابعاً: أوزع ذرتي O حول الذرة المركزية C ، وأرسم رابطة أحادية بين ذرة الكربون وذرتي الأكسجين، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).
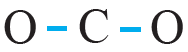
خامساً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 8 – 2 = 6
سادساً: أوزع الأزواج المتبقية على ذرتي الأكسجين:
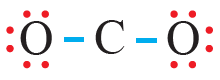
لاحظ أن قاعدة الثمانية لم تتحقق لذرة الكربون؛ لذا نحول زوجين غير رابطين إلى زوجين رابطين من الإلكترونات، فتصبح الرابطة بين ذرة الكربون وذرتي الأكسجين ثنائية.

- عدد أزواج الإلكترونات الرابطة: (4) أزواج.
- عدد أزواج الإلكترونات غير الرابطة على الذرة المركزية: (0) زوج.
- عدد أزواج الإلكترونات غير الرابطة على كل ذرة أكسجين: (2) زوج.
- عدد أزواج الإلكترونات غير الرابطة في الجزيء: (4) أزواج.
مثال (3):
أكتب تركيب لويس لجزيء الإيثين C2H4 . (العدد الذري لذرة C = 6 ، وللذرة H = 1).
الحل:
أولاً: أحدد عدد إلكترونات التكافؤ لذرات الجزيء:
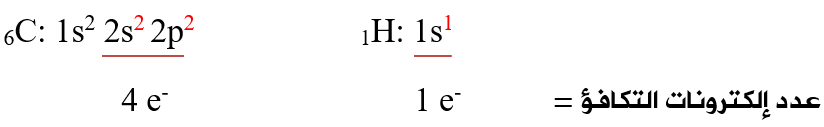
ثانياً: أحدد عدد إلكترونات التكافؤ الكلي لجميع ذرات الجزيء:
عدد إلكترونات التكافؤ الكلي = (عدد إلكترونات تكافؤ C × عدد ذراته) + (عدد إلكترونات تكافؤ H × عدد ذراته)
n(v.e.p) = = 6
ثالثاً: أوزع ذرات H حول الذرتين المركزيتين C ، وأرسم رابطة أحادية بين ذرات الكربون وذرات الهيدروجين، ورابطة أحادية بين ذرتي الكربون، وتمثل كل رابطة زوج رابط من الإلكترونات (b.e.p).
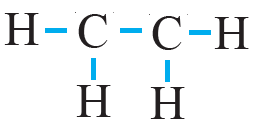
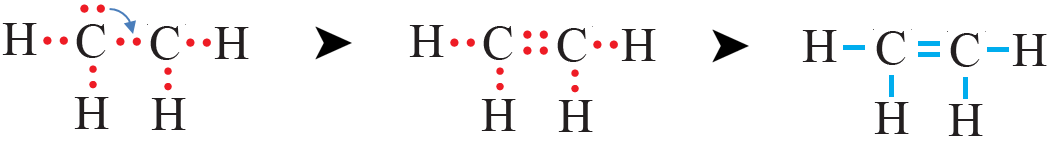
رابعاً: أحسب عدد أزواج الإلكترونات المتبقية (l.e.p) وتساوي:
n(l.e.p) = n(v.e.p) – n(b.e.p) = 6 – 5 = 1
الزوج المتبقي من الإلكترونات يتم تحويله إلى زوج رابط بين ذرتي الكربون لتحقق قاعدة الثمانية، فتصبح الرابطة بين ذرتي الكربون ثنائية.
إعداد : أ. أحمد الحسين
16 / 09 / 2022
النقاشات