تأثير الأيون المشترك
في هذا الدرس سنتعامل مع حالتين، هما:
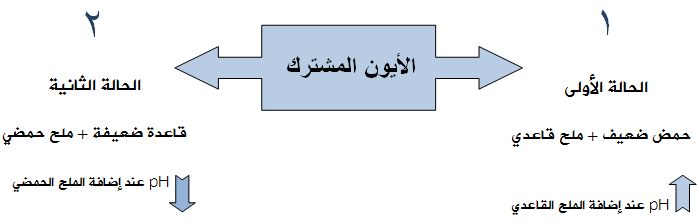
الحالة الأولى: (تعليل)
ماذا يحدث لقيمة pH عند إضافة محلول سيانيد الصوديوم NaCN (ملح قاعدي) إلى محلول حمض الهيدروسيانيكHCN (حمض ضعيف)؟
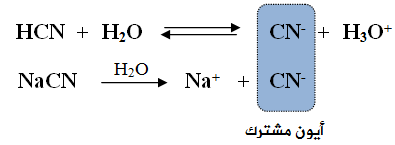 يتحلل حمض الهيدروسيانيك في الماء وفق المعادلة:
يتحلل حمض الهيدروسيانيك في الماء وفق المعادلة:
يتحلل ملح سيانيد الصوديوم في الماء وفق المعادلة:
عند إضافة الملح NaCN إلى محلول الحمض الضعيف HCN ، سوف يؤدي إلى زيادة تركيز الأيون المشترك (CN-)، ونتيجة لذلك سوف يندفع الاتزان في معادلة الحمض الضعيف بالاتجاه العكسي، مما يسبب نقصان تركيز أيون H3O+ ، وزيادة قيمة pH .
الحالة الثانية: (تعليل)
ماذا يحدث لقيمة pH عند إضافة ملح كلوريد الأمونيوم NH4Cl (ملح حمضي) إلى محلول الأمونياNH3 (قاعدة ضعيفة)؟
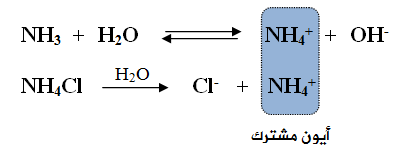 تتحلل الأمونيا في الماء وفق المعادلة:
تتحلل الأمونيا في الماء وفق المعادلة:
يتحلل ملح كلوريد الأمونيوم في الماء وفق المعادلة:
عند إضافة الملح NH4Cl إلى محلول القاعدة الضعيفة NH3 ، سوف يؤدي إلى زيادة تركيز الأيون المشترك (NH4+)، ونتيجة لذلك سوف يندفع الاتزان في معادلة القاعدة الضعيفة بالاتجاه العكسي، مما يسبب نقصان تركيز أيون OH- ، ونقصان قيمة pH .
سؤال :
وضح أثر إضافة ملح ميثانوات الصوديوم HCOONa إلى محلول حمض الميثانويك HCOOH .
الحسابات المتعلقة بالأيون المشترك
أولاً: إضافة ملح قاعدي إلى محلول حمضه الضعيف
مثال (1):
احسب قيمة pH لكل من:
أ - محلول حمض الإيثانويك CH3COOH بتركيز 0,2 مول/لتر (Ka = 2 × 10-5).
ب- محلول مكون من حمض الايثانويك CH3COOH (0,2 مول/لتر)، وملح ايثانوات الصوديوم CH3COONa (0,4 مول/لتر).
الحل:
مثال (2):
احسب قيمة pH لكل من:
أ- محلول أمونيا NH3 تركيزه 0,2 مول/لتر (Kb = 2 × 10-5).
ب- محلول مكون أمونيا NH3بتركيز 0,2 مول/لتر، وملح كلوريد الأمونيوم NH4Cl بتركيز 0,2 مول/لتر. (لـو 5 = 0,7).
الحل:
لاحظ انخفاض قيمة pH عند إضافة ملح حمضي (NH4Cl) إلى الأمونيا (11,3 - 9,3).
سؤال :
- احسب قيمة pH لمحلول تركيزه 0,01 مول/لتر من القاعدة N2H4 (Kb = 1 × 10-6).
- احسب قيمة pH للمحلول السابق إذا أضيف إلى لتر منه 0,01 مول من الملح N2H5NO3 .
إعداد : أ. أحمد الحسين
06 / 05 / 2022
النقاشات