
الأمينات: مركبات عضوية مشبعة، تحتوي على مجموعة أمين NH2 كمجموعة وظيفية وتحمل الصيغة العامة: RNH2
وتعد الأمينات المشتقات العضوية للأمونيا NH3 .
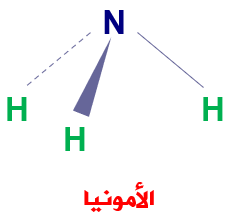
وإذا حلت مجموعة ألكيل (R) محل ذرة هيدروجين أو أكثر في الأمونيا يتكون الأمين.
أقسام الأمينات:
1- أمينات أولية وتحمل الصيغة العامة: RNH2

2- أمينات ثانوية وتحمل الصيغة العامة: R2NH

3- أمينات ثالثية وتحمل الصيغة العامة: R3N

أمثلة:

سؤال (1):
صنف الأمينات التالية إلى أمينات أولية أو ثانوية أو ثالثية:
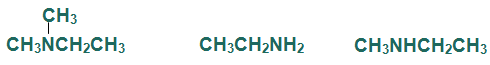
تسمية الأمينات:
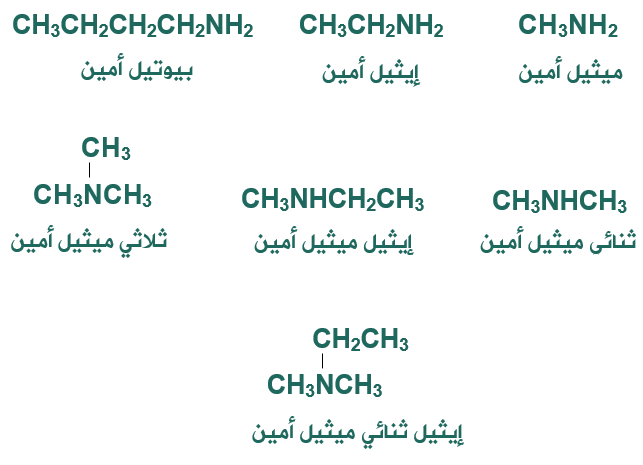
- تسمى الأمينات بتسمية مجموعة أو مجموعات الألكيل (R) المتصلة بذرة النيتروجين تتبعها كلمة أمين، وترتب مجموعات الألكيل أبجدياً.
- إذا احتوى الأمين على مجموعات ألكيل متماثلة تُستخدم البادئة (ثنائي أو ثلاثي).
أمثلة:
التسمية النظامية للأمينات الأولية
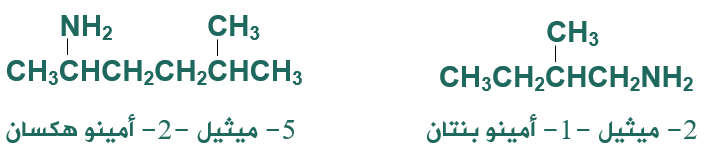
- أحدد أطول سلسلة كربونية متتابعة.
- أسمي مجموعات الألكيل إن وجدت مسبوقة بأرقامها.
- أضع رقم ذرة الكربون المتصلة بمجموعة الأمين.
- أكتب كلمة أمينو ثم اسم أطول سلسلة كما تسمى الألكانات.
أمثلة:
سؤال (2):
أكتب الصيغة البنائية للمركبات العضوية الآتية:
- 2- ميثيل -2- أمينو هكسان.
- هكسيل ميثيل أمين.
- ثلاثي إيثيل أمين.
الخصائص الفيزيائية للأمينات
تعتبر الأمينات مركبات قطبية؛ لاحتوائها على مجموعة أمين قطبية، وتترابط جزيئات الأمينات فيما بينها بروابط هيدروجينية (ما عدا الأمينات الثالثية)، إلا أن الرابطة الهيدروجينية في الأمينات أضعف من الرابطة الهيدروجينية في الكحولات؛ نظراً لكون الرابطة (N - H) في الأمينات أقل قطبية من الرابطة (O - H) في الكحولات، وذلك يعود لكون السالبية الكهربائية للنتروجين أقل من السالبية الكهربائية للأكسجين؛ ما يقلل من قطبية الرابطة بين الهيدروجين والنتروجين.
درجات الغليان
- درجات غليان الأمينات أعلى من درجات غليان الألكانات المقابلة؛ نظراً لوجود الرابطة الهيدروجينية بين جزيئاتها والتي ترفع من درجات الغليان، بينما تترابط الألكانات بقوى لندن الضعيفة.
- تزداد درجات غليان الأمينات بزيادة الكتلة المولية.
- درجات غليان الأمينات أقل من الكحولات المقاربة لها في الكتلة المولية؛ نظراً لكون الرابطة الهيدروجينية فيها أضعف من الكحولات.
الذائبية في الماء
تذوب الأمينات في الماء؛ لقدرتها على تكوين روابط هيدروجينية مع الماء، وتقل ذائبية الأمين بزيادة عدد ذرات الكربون؛ بسبب تأثير مجموعة الألكيل غير القطبية.
إعداد : أ. أحمد الحسين
03 / 04 / 2024
النقاشات