الرقم الهيدروجيني
pH
نظراً لصعوبة التعامل مع الأسس السالبة في تركيز H3O+ ، فقد تم الاتفاق على التعبير عنه بما يعرف بالرقم الهيدروجيني pH .
الرقم الهيدروجيني: اللوغاريتم السالب للأساس 10 لتركيز أيون الهيدرونيوم H3O+ في المحلول.
أي أن:
pH = - لــو [H3O+]
علاقة الرقم الهيدروجيني بتركيز أيون الهيدرونيوم وتركيز أيون الهيدروكسيد وطبيعة المحلول:
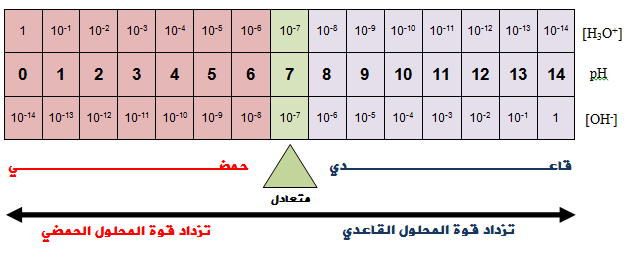
- إن زيادة قوة المحلول الحمضي تؤدي إلى زيادة [H3O+] مما يؤدي إلى نقصان pH .
- وإن زيادة قوة المحلول القاعدي يؤدي إلى زيادة [OH-] مما يؤدي إلى زيادة pH .
ملاحظات:
1- لــو 1 = صفر (حفظ).
2- لــو 10 = 1 (حفظ).
3- إذا كان [H3O+] = 1 × 10–ن ، فإن pH = ن
سؤال (1):
احسب الرقم الهيدروجيني (pH) في الماء النقي.
الحل:
في الماء النقي يكون [H3O+] = [OH-] = 1 × 10-7 مول/لتر.
pH = - لـو [H3O+]
= - لـو (1 × 10-7)
= - ( لـو 1 + لـو 10-7)
= - لــو 1 - لـو 10-7
= - لــو 1 + 7 لـو 10
= صفر + (7 × 1)
= 7 (متعادل)
سؤال (2):
احسب قيمة (pH) لمحلول يبلغ [H3O+] فيه 0,002 مول/لتر. (لـو 2 = 0,3)
الحل:
[H3O+] = 2 × 3-10 مول/لتر
pH = - لـو [H3O+]
= - لـو ( 2 × 10-3)
= - لـو 2 – لـو 10-3
= - لــو 2 + 3 لـو 10
= -0,3 + ( 3 × 1)
= 2,7 المحلول حمضي ( لأن pH أقل من 7 )
سؤال (3):
احسب قيمة (pH) لمحلول يبلغ [OH-] فيه 5 ×10-4 مول/لتر. (لـو 2 = 0,3) ، (Kw = 1 × 10-14).
سؤال (4):
إذا علمت أن قيمة (pH) لأحد محاليل الأحماض = 3 ، احسب [H3O+] .
الحل:
pH = - لــو [H3O+]
pH - = لــو [H3O+]
[H3O+] = 10pH-
= 3-10 = 1 × 3-10 مول/لتر.
ملاحظة:
إذا كانت قيمة pH كسرية، فإن القيم تستخرج من الأعداد المقابلة للوغاريتم.
سؤال (5):
احسب تركيز أيون الهيدرونيوم في محلول قيمة pH)) فيه 3,52 . (لـو3 = 0,48)
الحل:
pH = - لــو [H3O+]
pH - = لــو [H3O+]
[H3O+] = 10-pH
[H3O+] = 3,52-10
= 10(-4 + 0,48)
= 0,4810 × 4-10
= 3 × 4-10 مول/لتر.
سؤال (6):
احسب [H3O+] و [OH-] لكلٍ من:
1- محلول رقمه الهيدروجيني 4,22 . (لــو 6 = 0,78)
2- عينة دم إنسان قيمة pH لها = 7,4 . (لــو 4 = 0,6)
3- عينة من عصير برتقال رقمها الهيدروجيني = 5,8 . (لــو 1,6 = 0,2)
سؤال (7):
أكمل الفراغات في الجدول التالي:
|
المحلول |
[H3O+] |
[ |
pH |
طبيعة المحلول |
|
1 |
1 |
|
|
|
|
2 |
|
1 × 6-10 |
|
|
|
3 |
|
|
2 |
|
إعداد : أ. أحمد الحسين
08 / 08 / 2020
النقاشات